Praktikum vom 15. Juli – 26.Juli 2024
von Amelie Ubben, Emily Wilhelm, Hannah Behrends und Sophie Koppmeier
Im Rahmen der Auricher Wissenschaftstage hatten wir - Amelie Ubben, Emily Wilhelm, Hannah Behrends und Sophie Koppmeier - die einmalige Möglichkeit vom 15. Juli bis zum 26. Juli 2024 ein zweiwöchiges Praktikum im Heidelberger Life- Science-Lab des DKFZ (Deutsches Krebsforschungszentrum) zu absolvieren. Die Abteilung des Heidelberger Life-Science-Lab am Deutschen Krebsforschungszentrum ermöglicht durch sein Schüler-Forschungslabor naturwissenschaftlich sowie mathematisch interessierten Schülern und Schülerinnen praktische Laborerfahrung auf individueller Basis zu gewinnen. Unter der kompetenten Praktikumsbetreuung durch Anja Klefenz sowie Angela Funk wurden wir durch die zwei Wochen geführt.
Der erste Tag startete mit einer herzlichen Begrüßung durch Anja Klefenz und einer anschließender Vorstellungsrunde. Neben uns „Aurichern“ nahmen zwei weitere Praktikantinnen, die durch die Teilnahme am Wettbewerb Jugend forscht die Möglichkeit am Praktikum erlangten, daran teil, sodass wir die kommenden Wochen zu sechst bestritten haben. Nach der vorschriftsgemäßen Sicherheitseinweisung gingen wir voller Vorfreude das erste Mal ins Labor. Dort angekommen erhielten wir Kittel und wurden mit unserem Arbeitsplatz vertraut gemacht, bevor wir eine Einweisung für die Geräte, wie den Pipetten bekamen. Am Nachmittag begannen wir mit dem ersten Themengebiet, nämlich den protein-biochemischen Methoden. Dafür setzten wir SDS-Gele zur Proteinbestimmung an. Zuerst erfolgte die Herstellung des Trenngels und anschließend des Sammelgels, in dem sich der Kamm für die Kammern befindet. Die beiden Schichten wurden durch Isopropanol getrennt, sodass eine vollständige Trocknung ohne Luftbläschen resultiert. Außerdem bereiteten wir eine Agarmischung für das Themengebiet der Molekularbiologie vor, um zwei Arten von Antibiotika mit einem Bakterienstamm zu untersuchen. Diese musste vorerst autoklaviert werden, um sie am Folgetag zu verwenden. Damit endete der erste Tag unseres Praktikums.
Nachdem die SDS-Gele über Nacht im Kühlschrank waren, konnten wir sie am Dienstag mit den Proben befüllen. Die Proben mussten wir nach Anleitung pipettieren und bei 95 Grad für 5 Minuten erhitzen sowie kurz zentrifugieren, sodass sich die Proteine entfalten konnten und lediglich die Aminosäureketten in der Primärstruktur vorlagen. Anschließend trugen wir vier Proben mit unter-schiedlicher Konzentration an BSA (Bovines Serum Albumin), eine mit FCS (Fetal Calf Serum) sowie den Marker in die Kammern des Vertikal-Gels auf und starteten die Gelelektrophorese, in dem wir an diese über die Mittagspause eine Spannung anlegten. Mit einem Spaten lösten wir unser SDS-Gel vorsichtig von den Glasplatten und trennten das Sammelgel vom Trenngel. Das übrige Trenngel wurde über Nacht mit der Coomassie Lösung aus Essigsäure, Ethanol und blauen Farbstoff gefärbt, sodass die Banden der Proteine auf dem Gel sichtbar wurden. Um eine bestmögliche Färbung zu erhalten, deckten wir die Gele mit Parafilm ab und stellten diese auf den Schüttler. Anschließend führten wir eine Proteinbestimmung nach Bradford durch, zur Bestimmung der unbekannten Konzentration der FCS-Probe. Hierfür setzten wir eine Proteinbestimmungslösung an und erhielten acht Proben mit unterschiedlicher BSA Konzentration sowie die FCS-Probe. Die hergestellten Proben analysierten wir mit Hilfe eines Proteinanalysegeräts. Die Werte haben wir in ein Diagramm übertragen und anschließend eine lineare Regression erstellt, sodass wir die Konzentration der unbekannten FCS Lösung am Graphen ablesen konnten. Bevor wir uns erneut mit der Molekularbiologie beschäftigten und die Agarplatten für den morgigen Tag goßen, hatten wir eine Theorieeinheit zum Thema Proteinbiochemie. Für die Agarplatten verwendeten wir zwei Platten mit dem Antibiotikum Kanamyzin und eine mit Ampicillin. Zum Schluss hat Frau Klefenz die Minipräp angeimpft, die wir am Mittwoch für die DNA-Extraktion benötigten.
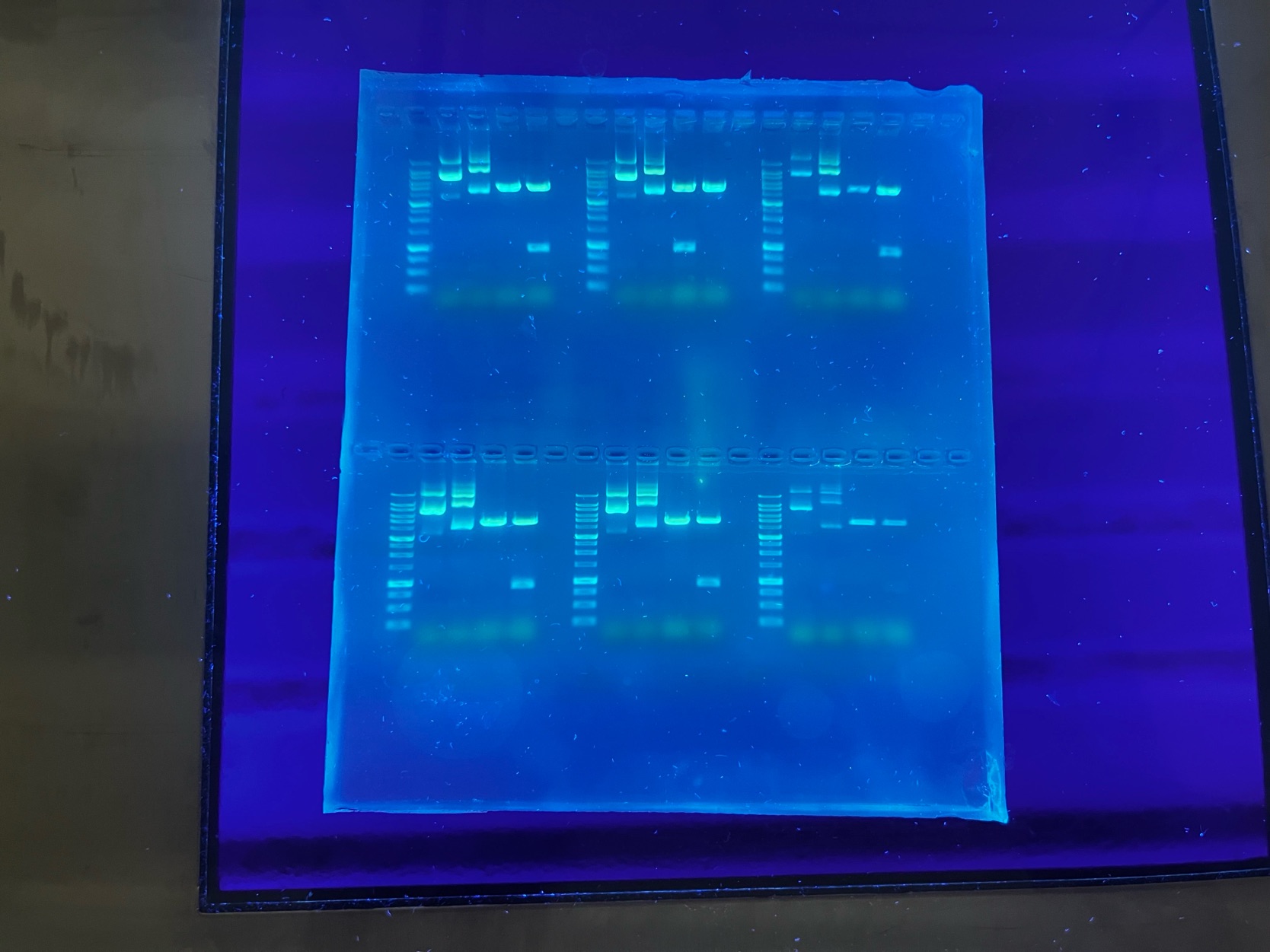
Am Mittwoch entfärbten wir die SDS-Gele und beendeten das Themengebiet der proteinbiochemischen Methoden mittels der Fotografie sowie Auswertung der Pro- teingele. Nun konnten wir uns vollständig der Molekularbiologie zuwenden. Im Labor führten wir neben der Gelelektrophorese auch eine Plasmid-Minipräparation durch, um Plasmid-DNA zu isolieren. Dazu kultivierten wir über Nacht eine Bakterienkultur mit Kanamycin-resistenten Bakterien. Am nächsten Tag ernteten wir die Kultur und isolierten die DNA. Anschließend verwendeten wir Restriktionsenzyme, um zwei Plasmid-DNA-Lösungen in definierte Fragmente zu zerlegen. Die Analyse der verdauten und unverdauten DNA erfolgte durch eine Gelelektrophorese auf einem Agarosegel, wobei die linearisierten Fragmente unter UV-Licht sichtbar gemacht wurden. Daraufhin führten wir mit einer der DNA-Lösungen eine Transformation durch, bei der wir die DNA in Bakterien einbrachten. Auf den von uns angefertigten Agarplatten konnten wir beobachten, dass die transformierten Bakterien ebenfalls Kanamycin-resistent waren und lediglich auf der Ampicillin-Platte kein Bakterienwachstum erkennbar war.
In den bereits vergangenen Tagen konnten wir uns mit den Methoden im Labor sowie mit dem Equipment vertraut machen, sodass wir am Donnerstag mit der Zellbiologie an den sterilen Werkbänken beginnen konnten. Die sterile Arbeitstechnik übten wir an sogenannten adhärenten HeLA-Zellen (Gebärmutterhalskrebszellen) und passagierten diese von einer Zellkulturflasche in eine weitere, nachdem wir sie nach einem bestimmten Splitfaktor geteilt haben.
Zusätzlich ermittelten wir die Anzahl der Jurkat-Zellen (Leukämie-Zellen) mit der Neubauer-Zählkammer unter dem Mikroskop, um die Konzentration in der Lösung zu bestimmen. Daraufhin induzierten wir bei einem Teil der Jurkat-Zellen den programmierten Zelltod (Apoptose) durch die Zugabe eines Todesliganden, während wir bei dem anderen Teil der Zellen die Nekrose durch Erhitzen herbeiführten. Nach der Induktion beider Zellsterbeprozesse analysierten wir die Zellpopulation mithilfe eines Durchflusszytometers. Diese Technik ermöglicht eine quantitative Bestimmung der Anteile lebender, apoptotischer und nekrotischer Zellen in der Probe. Im Mikroskop konnten wir auch morphologische Unterschiede erkennen. Apoptotische Zellen hatten eine verringerte Größe und ein Zerfall der Zellen in Vesikel war sichtbar. Für nekrotische Zellen war vor allem die irreversible Schwellung sowie die Zelllyse, also das Aufplatzen der Membran, die Freisetzung der DNA und der Zellorganellen in den Extrazellularraum typisch.
Am Ende der ersten Woche führten wir eine Transfektion von HEK-Zellen (human embryonal kidney cells) mittels der Calciumphosphat-Methode durch. Bei dieserMethode werden DNA-Kristalle erzeugt, die anschließend auf die adhärenten Zellen pipettiert werden. Um die Effizienz der Transfektion zu überprüfen, wie gut die Zellen die DNA-Kristalle aufgenommen hatten, analysierten wir die Zellen unter einem Fluoreszenzmikroskop. Dabei konnten wir eine grüne Fluoreszenz beobachten, was darauf hindeutet, dass die Transfektion erfolgreich war.
In der zweiten Woche waren unsere Tage in zwei Abschnitte unterteilt, vormittags wurden uns die verschiedenen Abteilungen des DKFZ vorgestellt. Dies geschah mit Hilfe spannender Vorträge nachmittags haben wir weiterhin im Labor gearbeitet.
Am Montag der zweiten Woche besuchten wir am Vormittag das Zentrum für präklinischen Forschung, das auch als „Tierhaus“ bezeichnet wird. Dort leben rund 50000 Mäuse und Ratten und auch einige Meerschweinchen. Die Tierpflegemeisterin Anja Rathgeb erklärte uns, dass diese Tiere dort unter optimalen Bedingungen gehalten und gepflegt werden. Danach durften wir uns selbst ein Bild davon machen. Dabei stellten wir fest, dass der oft negativ behaftete Begriff „Tierversuche“ nicht die Realität widerspiegelt. Generell müssen Tierversuche zuvor beantragt werden und in diesem das genaue Verfahren notiert werden, also wer mit dem Tier wie experimentieren darf. Dabei gibt es strenge Regelungen, die dafür sorgen, dass der Versuchs bei beispielsweise einer bestimmten Tumorgröße abgebrochen werden muss. Eine solche Antragsgenehmigung kann bis zu 12 Monate dauern und muss mehrere Stationen deutschlandweit durchlaufen.
Häufig werden Bilder aus dem Kontext gerissen und so Falschinformationen verbreitet. Daher war es uns nicht gestattet, dort Fotos zu machen. Neben dem Hauptbereich des Tierhauses besichtigten wir zusätzlich die Aquahaltung, in der die Frösche gehalten werden. Allerdings wird diesen nichts injiziert, sondern lediglich die Eizellen zur Forschung verwendet.
Der nächste Abteilungsbesuch führte uns in die Medizintechnik. Dort zeigte uns Armin Runz mithilfe von 3D-gedruckten Schädeln, Bauchspeicheldrüsen, Gehirnen und weiteren Körperteilen, wie diese Technologien zu einem besseren Verständnis des menschlichen Körpers sowie bei Therapieansätzen für Krebs beitragen. Er berichtete, dass sich die Medizintechnik in den letzten Jahren stark weiterentwickelt hat, sowie mittlerweile auch im klinischen Bereich fest etabliert ist und sich dies in Zukunft auch weiter ausbauen wird, was er an einem „lebensechten“ Fuß aus verschiedenen Dichtegraden demonstrierte. Nachdem wir die Drucker besichtigen durften, bekamen wir einen selbst gemachten, personalisierten Schlüsselanhänger als Andenken. Wir haben uns sehr über diese schöne Kleinigkeit gefreut und bedanken uns recht herzlich dafür!
Am Nachmittag arbeiteten wir erneut an den Sterilwerkbänken mit den HeLa-Zellen, die wir bereits am Donnerstag der vorherigen Woche vorbereitet hatten. Diese plattierten wir in eine 6-Well-Platte auf Deckgläschen aus. Dienstag besuchten wir die Stabstelle Strahlenschutz und Dosimetrie.
Die Strahlentherapie ist eine Therapiemöglichkeit für Krebspatienten. Um diese zu erforschen, steht sowohl die Sicherheit der Wissenschaftler als auch die der Technischen Assistenten an oberster Stelle. Deshalb gibt es im DKFZ für diese Bereiche den Strahlenschutz, der sich um die Sicherheit kümmert. Dipl.-Physiker Jens Lang erklärte uns nicht nur seinen Arbeitsbereich, sondern auch welcher physikalische Hintergrund hinter den unterschiedlichen Strahlungen steckt.
Anschließend besuchten wir die Abteilung für Durchflusszytometrie, wo uns Dr. Marcus Eich in einem faszinierenden Vortrag erklärte, wie mithilfe eines Laserstrahls eine große Anzahl an Zellen vermessen, analysiert und sogar für die weitere Verwendung sortiert werden kann.
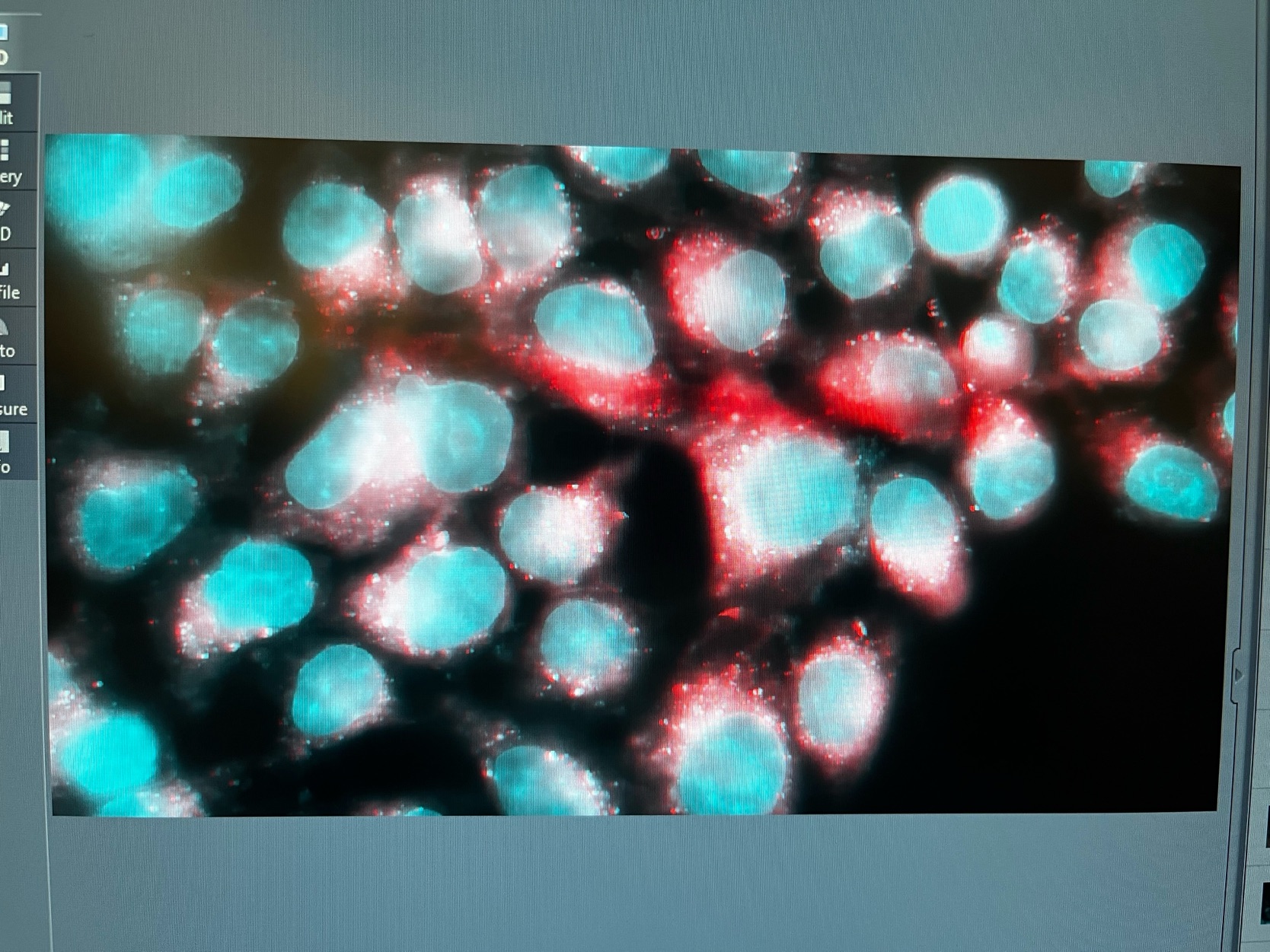
Zurück im Labor färbten wir die am vorherigen Tag ausplattierten Zellen ein. Dazu verwendeten wir einen Ansatz mit DAPI-Färbelösung, die DNA blau färbt und einen weiteren mit DAPI-Färbelösung und Mitotracker-RED, durch den die Mitochondrien rot gefärbt werden.
Ein Vortrag von Dr. Kristin Leyerer am Mittwoch thematisierte den Krebsinformationsdienst (KID). Diese Stelle bietet von Krebs betroffenen Menschen, Angehörigen aber auch Wissenschaftlern die Möglichkeit, bei Fragen, Sorgen und Unklarheiten rund um das Thema Krebs anzurufen, um fundierte und vor allem individuelle Informationen beziehungsweise Antworten zu erhalten. Besonders wichtig fanden wir die Unabhängigkeit des KID, da für diese Organisation Objektivität, Neutralität und Sachlichkeit bei dem Beratungsgespräch sehr von Bedeutung ist.
An diesem Tag führten wir nachmittags eine PCR (Polymerase-Kettenreaktion) durch. Dieses Verfahren wird zur Vervielfältigung der DNA verwendet. Wir setzten dazu zunächst eine Verdünnungsreihe mit dem Plasmid pEGFP-C1 an, die zu unterschiedlichen Konzentrationen des selben Plasmids in der Lösung führte. Bei dieser Reihe ließen wir die PCR einige Zyklen durchlaufen. Für die darauffolgende PCR,die sogenannte Colony-PCR, pickten wir Bakterien von einem Nährboden und vermehrten deren DNA.
Am Donnerstag besuchen wir den „7-Tesla“-Resonator, der für die Magnetresonanztomografie (MRT) und Spektroskopie verwendet wird. Dr. Stephan Orzada erläuterte uns die erheblichen Unterschiede in der Effektivität und Auflösung zwischen 1,5- bzw. 3-Tesla und den 7-Tesla-Resonatoren. Zudem durften wir die Stärke des Magnetfeldes selbst erforschen, indem wir einen Tennisball mit einer darin enthaltenen Metallmutter in das Gerät hielten und dieser mit gespanntem Seil in der Luft schwebte.
Unser letzter Vortrag wurde von Dr. Angela Schulz in der Abteilung der Hochdurchsatzsequenzierung gehalten. Dabei wurde uns erklärt, dass für die erste Genomsequenzierung mehrere Jahrzehnte benötigt wurden. Dank neuester Technik ist dies heutzutage in nur wenigen Tagen möglich. Die dafür genutzten Sequenzierer durften wir uns im Anschluss an den Vortrag anschauen. Jedes Gerät hat haben sie einen Wert von etwa 1,2 bis 2 Millionen Euro. Da Krebs durch individuelle Mutationen eigener Zellen entsteht, können diese durch die Genomsequenzierung ausfindig gemacht werden, was personalisiertere Therapien und verbesserte Behandlungsansätze ermöglicht.
Am Freitagvormittag beendeten wir unsere letzten Experimente und werteten die Ergebnisse davon aus. Wir betrachteten die von uns gefärbten HeLa-Zellen unter dem Mikroskop. Außerdem beluden wir Agarosegele mit den DNA-Lösungen, die zuvor die PCR durchliefen und führten so eine weitere Gelelektrophorese durch. Abschließend tauschten wir uns über die vergangenen zwei Wochen aus und kamen zu dem Entschluss, dass wir alle sehr viel Spaß am Praktikum hatten und sehr dankbar für eine solche Erfahrung sind. Dann wurde es Zeit für uns zum Bahnhof aufzubrechen, um unseren Zug zurück nach Aurich zu nehmen.
Zum Abschluss möchten wir unseren herzlichen Dank an die Auricher Wissenschaftstage aussprechen, die uns die einmalige Gelegenheit ermöglicht haben, ein Praktikum am Deutschen Krebsforschungszentrum (DKFZ) in Heidelberg zu absolvieren. Diese Zeit war nicht nur geprägt von intensiven Lehreinheiten, sondern vor allem eine Zeit voller spannender und inspirierender Erlebnisse. Wir durften tolle Erfahrungen sammeln, unvergessliche Erinnerungen schaffen und viele neue, nette Leute kennenlernen. Besonders danken wir Anja Klefenz und Angela Funk für ihre bemerkenswerte Vorbereitung und fürsorgliche Betreuung während unseres Praktikums. Ebenso möchten wir uns bei den verschiedenen Abteilungen des DKFZ bedanken, dass Sie uns ehrenamtlich viele aufschlussreiche Einblicke gegeben haben, insbesondere gegenüber den Referenten: Armin Runz, Dipl.-Phys. Jens Lang, Dr. Marcus Eich, Dr. Kristin Leyerer, Dr. Stephan Orzada und Dr. Angela Schulz