Von Anna Gerbers und Jula Wechselberg
07.10.2024 bis zum 18.10.2024
Im Rahmen der Auricher Wissenschaftstage durften wir (Anna Gerbers und Jula Wechselberg) erstaunliche Erfahrungen während eines zweiwöchigen Praktikums am Forschungszentrum Jülich sammeln. Wir begleiteten Forschende im Bereich des Instituts für Neurowissenschaften und Medizin (INM) und durften uns einen Eindruck von den Grundlagen der Biochemie verschaffen, aber auch die aktuelle Forschung an menschlichen und tierischen Gehirnen erkunden.
Nach einem freundlichen Empfang durch unsere Ansprechpartnerin Alexandra Drechsel besichtigten wir zunächst das Gelände des Instituts und unterzogen uns einer Sicherheitsunterweisung, welche von jedem Mitarbeitenden in gewissen Abständen durchzuführen ist. Sie thematisierte mögliche Gefahren bei der wissenschaftlichen Arbeit, allgemeines Verhalten im Labor und Unfallprävention. Während der monatlichen Überprüfung der Not- und Augenduschen in den Laboren konnten wir uns schon einen groben Überblick über die verschiedenen Arten und Funktionen der Labore verschaffen.So gibt es zum Beispiel ein Labor nur für den Autoklaven und ein Labor für die beiden Kryostaten.
Nach einer kurzen Mittagspause in der Kantine durften wir eines der Labore näher kennenlernen: Uns wurde die Arbeit mit dem Kryostaten demonstriert, mit welchem gefrorenes Gewebe, in diesem Fall das Gehirn einer Maus, geschnitten werden kann und anschließend auf Objektträgern in einem Gefrierschrank von -80°C gelagert wird, bevor die Schnitte eingebettet und haltbar gemacht werden.
Eine Studentin, die wir hier bei ihrem Projekt für die Masterarbeit begleiteten, berichtete uns vieles über die Möglichkeiten im naturwissenschaftlichen Studium.
Der zweite Tag unseres Praktikums begann direkt im Labor, da für die Studie der Masterstudentin noch 3 weitere Gehirne von Mäusen geschnitten werden mussten. Nachdem wir zwei der drei Gehirne fertig geschnitten und eingefroren hatten, ging es für uns in eine kurze Mittagspause und danach noch einmal ins Labor, um das letzte Gehirn zu schneiden. Gegen 14 Uhr waren alle 3 Gehirne fertig geschnitten und eingefroren und wir bekamen Arbeitsmaterial, um mehr über den Aufbau des menschlichen Gehirns und die Funktion von Rezeptoren zu lernen, da wir uns damit in den nächsten Tagen viel beschäftigen sollten. Um 15 Uhr ging es wieder ins Labor, diesmal aber in einem anderen Teil. Dort wurde einem anderen Mitarbeiter gerade ein menschliches Gehirn für die Forschung zur Verfügung gestellt und dieser zeigte uns dies.
Die nächste Stunde bestand dementsprechend aus dem Erklären und Betrachten des menschlichen Gehirns. Uns wurde näher gebracht, dass jedes menschliche Gehirn anders aussieht, da jeder Mensch unterschiedliche Regionen des Gehirns verschieden stark nutzt. So ist bei einem Musiker zum Beispiel der Teil des Gehirns, der für das Gehör zuständig ist mehr ausgeprägt als bei einem Bauarbeiter, bei dem dann aber zum Beispiel der Gleichgewichtssinn ausgeprägter ist. Außerdem wurde uns ein Einblick in die aktuellen Methoden zur Forschung von Nervenbahnen im Gehirn geboten und zum Schluss hatten wir noch die Möglichkeit das Gehirn selber in die Hand zu nehmen und es uns genauer anzuschauen, was definitiv einen ganz besonderen Eindruck hinterlassen hat. Danach endete unser Tag um ca. 16 Uhr.
Die nächsten Tage ging es um die verschiedenen Funktionen der angefertigten Schnitte im Labor. So wurde uns zum Beispiel die Patch-Clamp-Methode erklärt, bei der Strukturen und elektrische Ströme in Zellen, in diesem Fall menschlichen Neuronen, sichtbar gemacht werden können. Dabei wird eine kleine Elektrode an einer Pipette mit einem Durchmesser von ca. 1 Mikrometer an die Zellmembran geführt, um diese dann durch Unterdruck in die Pipette aufzusaugen.
Nach der Mittagspause durften wir Bilder von Neuronen unter dem Mikroskop anschauen sowie Methoden kennenlernen, um diese Bilder dreidimensional zu rekonstruieren. Diese Bilder werden dann genutzt, um die Verknüpfungen von verschiedenen Nervenzellen und Regionen im Gehirn besser nachvollziehen und erforschen zu können.
Für die virtuelle Darstellung der Nervenzellen im dreidimensionalen Raum wird unter anderem die VR-Brille verwendet.
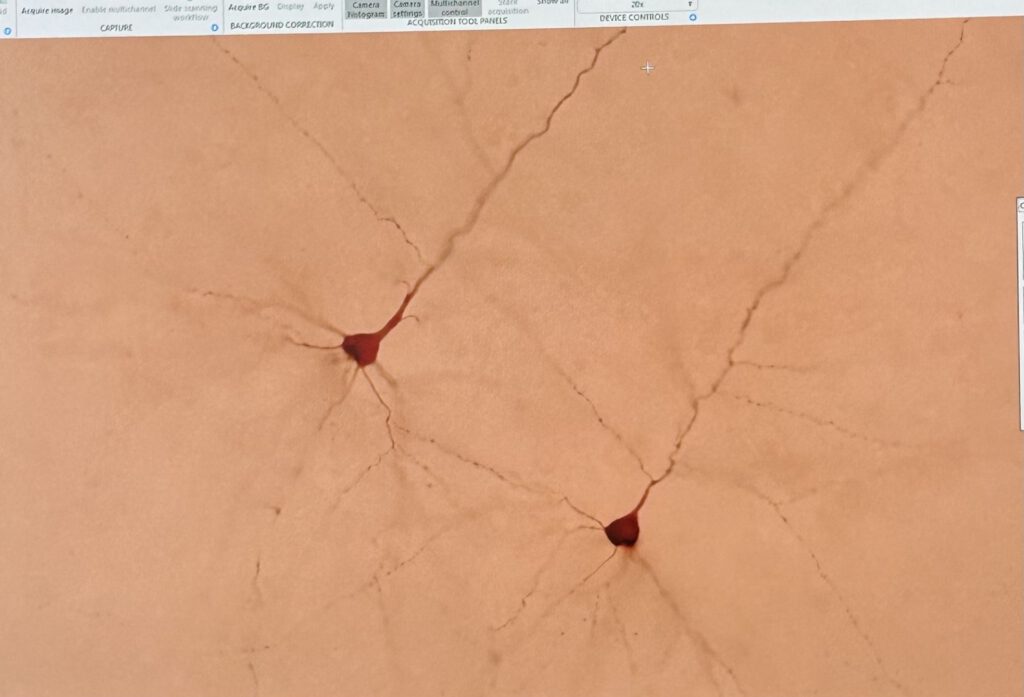
Anschließend wurde uns von einer Praktikantin die Arbeit mit dem Fluoreszenz-Mikroskop nähergebracht. Die mit einem fluoreszierenden Mittel bestrichenen Hirnschnitte werden mit UV-Licht bestrahlt. Besonders stark sichtbar wurden bei dieser Methode die Nervenzellen bei Patienten mit Krankheiten, wie Alzheimer oder Tumore, welche besonders stark fluoreszierten.
Der Donnerstag begann mit dem Kennenlernen eines weiteren Mitarbeiters, der uns erklärte, wie ein MRT funktioniert und aufgebaut ist. Dabei ging er auf den Nutzen des MRTs in der Forschung des Gehirns im wachen Zustand ein und wie die weitere Entwicklung in der Zukunft aussehen könnte.
Darauffolgend zeigte er uns ein abgeschaltetes 3 Tesla MRT, das aktuell nicht in Benutzung ist, da der Bereich des Labors noch fertiggestellt wird. Außerdem wurde uns das MRT für Mäuse und Ratten gezeigt, das deutlich kleiner ist und zusätzlich noch einen Narkosebereich besitzt, damit die Tiere ruhig halten und nicht in Stress geraten. Danach haben wir zusammen mit einer Mitarbeiterin die histologischen Schnitte, die wir Montag und Dienstag angefertigt haben, in einen Objektträgerständer eingeordnet, um diese in Paraffin zu stellen, damit diese am Freitag gefärbt werden können.
Um 13 Uhr ging es dann in ein Teammeeting, das jede Woche am Donnerstag stattfindet und bei dem die gesamte Arbeitsgemeinschaft zusammenkommt, um über Organisatorisches zu reden, z.B. um neue Materialanschaffungen für das Labor. Außerdem berichtete ein Mitarbeiter von seinem Besuch auf dem Sleep Congress Europe, wo er interessante Forschungsergebnisse von anderen Instituten zeigte. Dabei ging es unter anderem um den Einfluss unterschiedlicher Ernährung von Ratten auf ihren Schlaf.
Am Freitag lernten wir Neues kennen: zum einen ein neues Gerät zum Schneiden von Gehirnen. Das sogenannte Vibratom schneidet die in Agarose fixierten Gehirnhälften im Wasserbad in 210 Nanometer große Scheiben. Diese werden aufgefangen und gesondert in Wasser gelagert.
Zum anderen wandten wir die Golgi-Methode bzw. Golgi-Färbung an. Diese dient dazu, die Strukturen eines Neurons, wie z.B. Axone, sichtbar zu machen und funktioniert wie folgt: Nachdem die Agarose von den Schnitten entfernt wurde, wurden diese in ein Gemisch aus verschiedenen Lösungen gegeben, das die Schnitte durch Kontrasterhöhung dunkel färbt. Nach ungefähr zehn Minuten wurde diese Lösung abgewaschen und die Schnitte schrittweise entwässert. Dafür wurde eine aufsteigende Alkoholreihe verwendet: Die Schnitte befanden sich dafür zunächst in 50% Ethanol, danach in 70%, in 90% und schließlich in 100% Ethanol. Nach der Entwässerung fand die Einbettung der Schnitte auf Objektträgern statt. Das dazu verwendete Xylol ist hochgradig giftig, darf ausschließlich unter dem Abzug verwendet werden und wegen Verätzungen nicht mit Plastik in Berührung kommen. Das dickflüssige Xylol wird mit den Schnitten auf die Objektträger gegeben und für ungefähr zwei Wochen getrocknet, um diese dann unter dem Mikroskop zu analysieren. Obwohl Xylol hochgradig giftig ist wird es dennoch als Einbettungsmittel genutzt, da es sich dafür sehr gut eignet.


Unsere zweite Woche begann mit einem Treffen mit Werner Hucko. Mit ihm wässerten wir Gehirnschnitte, indem wir ein ähnliches Verfahren anwendeten wie am Freitag. Danach setzten wir Agar-Nährboden an, damit wir in den folgenden Tagen Bakterien züchten
konnten. Die Flüssigkeit für den Nährboden wurde dann zwei Stunden in den Autoklaven gepackt, damit diese sterilisiert werden und keine Bakterien in der Lösung sind. In dieser Zeit führten wir mit Alexandra und unserer anderen Betreuerin Nadja eine
Kresylviolett-Färbung von Rattenhirnschnitten durch, bei dem man die Zellkerne einfärbte und sie somit unter dem Mikroskop sehen konnte. Dabei setzten wir die Objektträger im Objektträgerständer zuerst in die Kresylviolett-Mischung und später in eine aufsteigende Alkoholreihe, bei der genauso vorgegangen wurde wie die bei der Golgi-Färbung, nur das Propanol verwendet wurde. Danach wurden die Objektträger in eine Xylol-Ersatzlösung gegeben, dort verblieben sie erstmal für etwa eine Stunde. In dieser Zeit nahmen wir die Agar-Lösungen aus dem Autoklaven und gossen diese in sterile Platten. Dabei wurden zwei der Proben als “Spaß-Proben” genutzt, für die wir uns Gegenstände unserer Wahl aussuchten, wie z.B. unser Handy oder eine Türklinke, um diese in den folgenden Tagen auf das Vorhandensein von Bakterien zu untersuchen. Anschließend kehrten wird zu unseren eingefärbten Rattenhirnschnitten zurück, um die Schnitte mit einem Deckglas und Formalin zu fixieren. Diese sollten dann im Folgenden trocknen, damit wir sie am Ende unseres Praktikums mit nach Hause nehmen konnten.
Am Dienstag durften wir den Kryostat selbst bedienen und unsere eigenen Schnitte anfertigen. Wir verwendeten ein altes Mäusegehirn, welches von der Arbeitsgruppe nicht mehr benötigt wurde und fertigten Schnitte des Hippocampus und des Kleinhirns an, damit diese später z.B. von anderen Praktikanten gefärbt werden können.



Anschließend lernten wir die Diaminobenzidin-Färbung kennen. Bei dieser Methode nimmt die Nervenzelle eine braune Färbung an. Hierbei sind die Zellstrukturen zu sehen, also anders als bei der Kresylviolettfärbung, bei der die Zellkerne sichtbar wurden. Am Mittwoch betrachteten wir die finalen Resultate der DAB Färbung des vorherigen Tages unter dem Mikroskop und konnten somit die Zellstrukturen der Nervenzelle sehr gut erkennen. Im folgenden legten wir Bakterienkulturen an, bei denen eine kleine Menge an Bakterien auf unseren Nährboden gegeben und mit einem, durch einen Bunsenbrenner sterilisierten Metallstab auf der Fläche verteilt wurde. Die fertigen Kulturen kamen dann für etwa 20 Stunden in einen 37 Grad warmen Brutkasten.
Nach dem fertigen Anlegen der Bakterienkulturen schauten wir bei der Sektion von zwei Ratten zu, die von den beiden anderen Praktikantinnen durchgeführt wurde. Dadurch konnten wir die Anatomie einer Ratte näher kennenlernen. Der Tag endete mit dem Versuch einer DNA-Extraktion einer Banane, die jedoch nicht gelang und deswegen am Freitag noch einmal mit einer Tomate durchgeführt werden sollte.
Am Donnerstagmorgen führten wir Versuche mit den angesiedelten Bakterienkulturen durch, zuerst den Katalasetest. Dabei wurde ein Teil der Bakterienkultur auf eine dreiprozentige H 2 O 2 – Lösung (Wasserstoffperoxid) gegeben. Das in den Bakterien enthaltende Enzym Katalase zersetzte das Wasserstoffperoxid zu Sauerstoff und Wasser, was dazu führte, dass die Lösung sprudelte und der Test auf Katalase somit positiv war. Zudem führten wir die Gram-Färbung durch. Das fertige Färbungskit bestand aus fünf Lösungen (Kristallviolettlösung, Lugolsche Lösung, zweimal Entfärbelösung und Safraninlösung) und einer genauen Anleitung zum Färben der Bakterien. Nachdem ein Teil der Bakterienkultur großflächig mit einer Natriumchloridlösung auf einem Objektträger verrieben wurde und auf diesem durch Hitze fixiert wurde, wurden schrittweise die verschiedenen Lösungen auf den Objektträger gegeben, sodass die Bakterienkultur gefärbt war und mikroskopiert werden konnte.
In der zweiten Tageshälfte berichtete uns eine Doktorandin von ihrem Projekt zur Synapsendichte bei verschiedenen Mäusen. Bei diesem Projekt wurden die Neuronen von drei Mäusegruppen untersucht. Die Mäuse der ersten Gruppe erwachten gerade aus dem Schlaf, die der zweiten Gruppe waren am Ende einer wachen Phase und die der dritten Gruppe litten unter Schlafentzug. Zwischen den verschiedenen Gruppen lassen sich deutliche Unterschiede in der Synapsendichte erkennen.
Unser letzter Tag begann mit einem gemeinsamen Rundgang über das Gelände des Forschungszentrums. Dabei wurden uns der Supercomputer, die Werkstätten und das JULAB (Jugendlabor) gezeigt. Danach ging es ein letztes Mal ins Labor, um unseren Arbeitsplatz aufzuräumen. Die benutzten Bakterienkulturen konnten nicht im normalen Müll entsorgt werden, sondern mussten zuerst noch autoklaviert werden. Während der Sterilisierung konnten wir die Ergebnisse unserer Gram-Färbung des Vortages unter dem Mikroskop ansehen. Dabei wurde uns deutlich wie viele Bakterien auf einem winzigen Abschnitt vorhanden sind und wie unterschiedlich diese aussehen können. Außerdem führten wir noch einmal die DNA-Extraktion einer Tomate durch. Dabei mörserten wir die Tomate mit Kochsalz, Spülmittel, Zitronensaft und Wasser. Diese Mischung filtrierten wir und gaben dann eisgekühlten Brennspiritus dazu. Durch die anschließende Kühlung der ganzen Mischung wurde die DNA sichtbar.

Nach Beendigung des Versuchs gingen wir wieder ins Büro zurück, um uns zu verabschieden.

In den zwei Wochen unseres Praktikums lernten wir die Arbeit von Biologielaborant*innen näher kennen und konnten uns ein genaueres Bild von deren Aufgaben verschaffen. Außerdem wurde uns der gesamte Prozess von der lebendigen Ratte bis zu fertigen Bildern von Neuronen auf dem Computer sehr ausführlich demonstriert. Auch in der Mikrobiologie durften wir neue Erfahrungen sammeln. Unser in der Schule erlerntes theoretisches Wissen konnten wir in dieser Zeit praktisch anwenden und somit viele neue Erfahrungen sammeln. Abschließend möchten wir einen besonderen Dank an die Mitarbeitenden des Forschungszentrums Jülich richten, an Alexandra Drechsel und Nadja Hermes, die uns über die zwei Wochen sehr aufmerksam betreut haben, an Werner Hucko und weitere Forscher*innen, die es uns ermöglichten, viele interessante Methoden der Mikrobiologie und Neurobiologie kennenzulernen. Aber auch bei den Auricher Wissenschaftstagen möchten wir uns ausdrücklich bedanken, da uns das Stipendium einzigartige Möglichkeiten geboten hat, die uns noch lange Zeit in Erinnerung bleiben werden.
Anna Gerbers und Jula Wechselberg









