Praktikum vom 17.10.2022 zum 28.10.2022
von Lara Fischer und Neele Hamacher
Dank den Auricher Wissenschaftstagen erhieltenir, Lara Fischer und Neele Hamacher, ein Stipendium für ein zweiwöchiges Praktikum am Forschungszentrum Jülich (FZJ) im Bereich Neurowissenschaften und Medizin (Hirnforschung). Dies absolvierten wir am Institut für Neurowissenschaften und Medizin 2 (INM-2).
„Das INM-2 widmet sich der Erforschung der molekularen Grundlagen unterschiedlicher Funktionssysteme im gesunden und erkrankten Gehirn sowie deren Organisation in neuronalen Netzwerken.“[1] Hierbei liegt der Schwerpunkt auf der Entschlüsselung von Grundlagen der Gehirnfunktion und deren Anpassung. Außerdem werden Folgen von Gehirnerkrankungen und resultierende Mechanismen untersucht. Methodisch werden hierzu moderne Bildgebungsverfahren (z.B. PET) verwendet. Das INM-2 hat Interesse an der Mitentwicklung neuer bildgebender Methoden.[2]
Nach unserer Ankunft am Sonntag (16.10.2022) im Gästehaus des FZJ ging es am Montag mit organisatorischen Dingen, wie zum Beispiel der Übergabe der Ausweise, Sicherheitsbelehrung und einer Laborführung los. Des Weiteren durften wir bei einer digitalen Geschäftsbesprechung sowie bei einer Projektvorstellung und -planung zuhören.
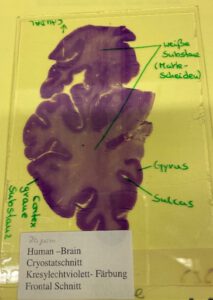
Am Dienstag haben wir eine Nisslfärbung mit Kresylechtviolett an Kryostatschnitten durchgeführt. Dafür haben wir Gehirnschnitte, die zuvor bei ca. -80°C auf Objektträgern eingefroren waren, bereits am Vortag aufgetaut und über Nacht in eine Formalinlösung gestellt. Diese haben wir dann für ungefähr 20 Minuten gewässert. Das bedeutet, dass man sie in ein Gefäß stellt, welches man mit niedrigem Wasserdruck volllaufen lässt. Dadurch wurden sie gespült. Bis zu diesem Zeitpunkt waren die Schnitte auf den Objektträgern kaum sichtbar. Daher folgte als nächster Schritt die Zellkerneinfärbung in einem Bad aus Kresylechtviolett für 15 Minuten. Danach lag eine Überschussfärbung vor, weshalb man als nächstes eine Dehydrierung und Differenzierung mit aufsteigender Propanol-(/Alkohol-)Konzentration (70%, 96%, 100%) durchführt, um überschüssigen Farbstoff zu entfernen. Der Vorteil dieses Verfahrens ist, dass eine Korrektur der Färbung zu jedem Zeitpunkt möglich ist. Die Zwischenergebnisse haben wir ab und zu unter einem Mikroskop kontrolliert. Der letzte Schritt bestand darin, den Alkohol mit einem Xylenersatz zu entfernen. Dafür stellte man die Präparate für 20 Minuten in die Lösung. Die Objekte waren somit fertig präpariert und wir konnten sie mit Deckgläschen und sogenanntem Safe Mount-Qpath (Eindeckmittel) eindecken und dann fest auf den Objektträgern fixieren. Die fixierten Präparate mussten nun für eine Woche trocknen. Während der Wartezeiten konnten wir uns verschiedene Schnitttechniken von Gehirngewebe unter einem Mikroskop anschauen. (Siehe Abb. 1-4)




Am Nachmittag haben wir an einem Retreat teilgenommen, bei dem Wissenschaftler verschiedene Projekte aus dem Bereich Hirnforschung vorgestellt haben. Der Retreat enthielt einerseits kurze Vorträge („Spotlights“), andererseits längere. Unter anderem wurde über Projekte zum Thema Alzheimer und Verletzungen im Gehirn berichtet. Durch die Internationalität am FZJ wird überwieged auf Englisch kommuniziert.
Am nächsten Tag (Mittwoch) haben wir uns am Vormittag weitere Vorträge angehört. Nachmittags stand eine Positronen-Emissions-Tomographie (PET) an, bei der Neele zuschauen durfte. Dafür ging es durch eine Schleuse in den Kontrollbereich, in dem mit radioaktiven Substanzen gearbeitet wird. Jeder in diesem Bereich bekommt ein Messgerät, das die radioaktive Aktivitätisst und die Strahlung, der man ausgesetzt war,omit dokumentiert werden kann. Die PET ist ein bildgebendes Verfahren der Nuklearmedizin, bei welchem Schnittbilder von lebenden Organismen produziert werden. Dies funktioniert mit Hilfe der Einnahmeiner radioaktiven Substanz. Die PET kann die Verteilung der radioaktiven Substanz im Organismus verdeutlichend somit können Aussagen, beispielsweise über den Stoffwechsel gemachterden. Dazu werden zunächst Rohdaten erzeugt welche in weiteren Schritten in Histogrammen dargestellterden. Außerdem werden Sinogramme erstellt, welche in einem letzten Schritt für eine Nachvollziehbarkeit und bessere Ansicht rekonstruiert werden. Nach Vorbereitungen musste die Untersuchung jedoch abgebrochen werden, da mit dem sogenannten Tracer (dem radioaktiven Stoff) etwas nicht stimmte. Dies hat uns gezeigt, dass bei der Forschung nicht immer alles im ersten Versuch
Am Donnerstag durfte Neele an einem Kryostat Gefrier-Gehirnschnitte anfertigen. Der Kryostat ist ein Gerät, in dem sehr tiefe Temperaturen erreicht und gehalten werden können und ein Schneideapparat integriert ist, mit dem im Nanobereich geschnitten werden kann. Man kann das Gehirn sagittal, koronar oder horizontal schneiden. Wir haben das Gehirn in koronarer Schnittebene bei ca. -20°C geschnitten. Hierzu wird das gefrorene Gehirn mit Hilfe eines Gefrierklebers vor dem Messer fixiert. In unserem Fall wurden dann jeweils 30 Schnitte von den Hirnregionen Striatum, Hippocampus und Kleinhirn angefertigt. Ein Schnitt ist 20 Mikrometer dünn. Jeder einzelne Schnitt wird auf einen adhäsiven Objektträger fixiert, welcher ebenso gefroren ist. Die Beschichtung dieser Objektträger sorgt dafür, dass die Schnitte ohne Weiteres darauf haften. Befindet sich der Schnitt auf dem Träger, wird dieser langsam auf eine 37 Grad Celsius warme Heizplatte geschoben und. Hierbei musste man darauf achten, dass dies langsam geschieht, da sich andernfalls Lustbläschen bilden können. Die fertigen Schnitte wurden dann wieder bei -80°C eingefroren. Danach durfte Neele noch zusehen, wie die Not- und Augenduschen getestet wurden. Dies wird einmal im Monat in jedem Labor durchgeführt. (Siehe Abb. 5-9)




Montag war, wie in der Vorwoche auch, eine digitale Arbeitsgemeinschafts-Besprechung. Zuvor haben wir noch an einer ausführlichen Arbeitsschutzunterweisung teilgenommen, die für alle Mitarbeiter verpflichtend war.
Im Anschluss durften wir uns einen interessanten Vortrag über Magnet-Resonanz-Tomografie (MRT) anhören. Es wurden uns die verschiedenen Bildgebungsmöglichkeiten vorgestellt (z.B. die Darstellung von Nervenfaserbündelnd die metabolische Darstellung). Daraufhin folgten die notwendigen Voraussetzungen für den MRT, zum Beispiel dass das Objekt Atomkerne mit magnetischem Moment besitzen muss sowie die Funktionsweise des MRT. Zur Funktionsweise gehört die Erzeugung eines starken Magnetfeldes (≥ 1 Tesla) und einer Radiofrequenz, die durch eine Spule erzeugt wird. Gesteuert wird die Bildgebung durch Veränderung der Magnetfelder. Die angeregten Atomkerne senden in ihrer Ausgangslage Signale, welche von der Spule empfangen werden. Diese Signale können dann in Bilder umgewandelt werden. Daran anschließend wurden uns Beispiele für klinische und wissenschaftliche Anwendungen erklärt. Unter anderem, dass das MRT keine nachzuweisenden Schäden im Körper mit sich bringt und dass man durch verschiedene Methoden das Bild auf den zu beobachtenden Bereich spezifizieren kann. Das bedeutet, man kann durch verschiedene Einstellungen und gegebenenfalls durch Injizieren bestimmter Stoffe den zu untersuchenden Bereich hervorheben. Je stärker das Magnetfeld ist, desto höher und genauer ist die Bildauflösung. So gibt es bereits wenige MRT, die Auflösungen bis in den mikroskopischen Bereich ermöglichen. Dies ist jedoch deutlich energieaufwändiger.
Im Anschluss durften wir noch einmal am Kryostaten in koronarer Ebene Gefrierschnitte (wie oben beschrieben) durchführen. (Siehe Abb. 10-14)





Am Dienstag durften wir uns ein anderes Institut, das INM-6, anschauen. Dies befasst sich mit Elektrophysiologie. Zuerst wurde uns unter dem Mikroskop ein gefärbtes Neuron gezeigt und das Verfahren, mit dem man es dreidimensional auf dem Computer mit Hilfe eines Programmes rekonstruieren kann. Dann ging es mit einem sogenannten Patch Clamp Verfahren weiter. Patch Clamp Recording ist eine elektrophysiologische Analysemethode, die zur Darstellung von Ionenströmen durch die Zellmembran verwendet wird. „Patch“ stellt dabei einen kleinen Abschnitt der Zellmembran, der von einer Messpipette berührt wird, dar. „Clamp“ steht für das während der Messung konstant gehaltene elektrische Potential.
Vorbereitend für diese Analysemethode wurde Gewebe entnommen und in eine mit Sauerstoff angereicherte Flüssigkeit gegeben. Dies dient dazu, die Nervenzellen am Leben zu halten. Infolgedessen wurde die bestimmte Hirnregion in 350 Mikrometer dünne Scheiben sagittal geschnitten. Die Schnitte wurden direkt nach dem Schneiden in einen Behälter gelegt, der mit Sauerstoffngereicherter Flüssigkeit befüllt war. Darin mussten die Schnitte für mindestens eine Stunde bleiben, damit die Nervenzellen, welche durch das Schneiden angeregt worden sind, sich beruhigen konnten.
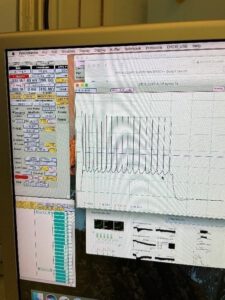
Nach dieser Pause wurde ein Schnitt unter einem Mikroskop befestigt. Dieses Mikroskop lässt sich per Joystick steuern. Des Weiteren waren Elektroden und eine feine Pipette mit dem Joystick steuerbar. Es wurde ein passendes, gesundes Neuron gesucht und in dieses wurde die feine Messpipette (Durchmesser 1 ) bis zu dem Ionenkanal vorgeschoben. Durch Ansaugen der Membran durch die Pipette kann an dieser Stelle das Elektronenpotential gemessen werden. Die Pipette ist hierzu an ein Spannungsmessgerät angeschlossen. Durch dieses Verfahren können Veränderungen am Membranpotenzial, zum Beispiel durch Drogen gemessen werden. Dadurch kann man wiederum Schlussfolgerungen auf die Auswirkungen im Körper ziehen. (Siehe Abb. 15-24)








Mittwoch haben wir bei den Vorbereitungen einer Autoradiografie zugesehen. Dies bezeichnet die Visualisierung und die quantitative Bestimmung einer chemischen Komponente (zum Beispiel die Anzahl von Rezeptormolekülen) durch Inkubieren von radioaktiven Nukliden.
Es erfolgte zuerst die Herstellung von radioaktiven Lösungen. In unserem Fall wurde Tritium verwendet. Tritium wurde in verschiedenen Konzentrationen in einer Pufferlösung angesetzt. Dieses bindet als Radioligand an die Rezeptoren einer bestimmten Hirnregion. Die Konzentrationen dienen dazu, eine Sättigung zu ermöglichen, Das bedeutet, das Ziel ist es mit den durch die Autoradiografie gewonnenen Werten eine Sättigungskurve zu erhalten. Gesättigt würde in diesem Fall bedeuten, dass alle Rezeptoren mit dem Liganden gebunden sind.
Am nächsten Tag wurden ausgewählte Gehirnschnitte zuerst in eine Vorinkubation gegeben. Dadurch wurden die noch gebundenen Rezeptoren von Substraten getrennt, sodass nur noch freie Rezeptoren vorlagen. Es folgte die Hauptinkubation, die den Radioliganden in verschiedenen Konzentrationen beinhaltet. Nach wiederum längerer Wartezeit erfolgte die Auswaschphase, in der nicht gebundene Liganden ausgewaschen wurden Dies wurde mit dem Dippen, welches dem Auswaschen des Puffers dient, beendet. Der ganze Vorgang wurde mit einem Kompetitor durchgeführt, da so berechnet werden kann, wie viele andere Liganden (die nicht radioaktiv markiert sind) an den gesuchten Rezeptor gebunden sind. So kann eine Verfälschung des Ergebnisses verhindert werden. Zum Schluss wurden die Schnitte unter dem Abzug mit einem Ventilator getrocknet. Nach der Arbeit haben wir Wischtests durchgeführt, um zu kontrollieren, ob Arbeitsflächen mit Radioaktivität kontaminiert sind.
An unserem letzten Tag (28.10.2022) haben wir zuerst zugeschaut, wie die Schnitte der Sättigung geklebt werden. Dies ist ein Verfahren, bei dem die Objektträger zugeschnitten werden und auf ein Blatt geklebt werden. Im Folgenden würden weitere Schritte folgen, durch die letztendlich die Auswertung der Autoradiografie am Computer möglich ist. Diese wurden jedoch erst in den nächsten Wochen durchgeführt. Des Weiteren sollte die PET-Messung vom 19.10.2022 wiederholt werden. Jedoch gab es erneut Probleme mit dem Tracer, weshalb der Versuch nicht stattfinden konnte. Zum Schluss durften wir unsere Schnitte, die wir am 18.10.2022 gefärbt hatten, mit nach Hause nehmen.
Lara hat außerdem an einer Studie teilgenommen, bei der man mit einem EEG verbunden wird und die Hirnströme unter verschiedenen äußeren Einflüssenrden.
Zusammenfassend ist das Ziel der oben beschriebenen Methoden neue Erkenntnisse über das Gehirn zu erforschen und bisher bekannte Methoden sowie Medikamente verbessern zu können. Über die aktuellen Forschungen im Detail dürfen wir aus Gründen der Verschwiegenheit nichts veröffentlichen. Deshalb konnten wir als Praktikanten nicht immer über alles in Kenntnis gesetzt werden.
Abschließend können wir sagen, dass wir in den zwei Wochen unseres Praktikums viele neue Erfahrungen sammeln konnten, die uns Eindrücke von der wissenschaftlichen Arbeit, sowie von der Laborarbeit gaben. Wir wollen uns somit herzlich beim Gymnasium Ulricianum, den Auricher Wissenschaftstagen, dem Forschungszentrum Jülich, insbesondere beim Team des INM-2 und unserer Betreuerin Alexandra Drechsel bedanken, die uns diese Chance ermöglicht haben.










